Pada reaksi sederhana yaitu reaksi yang berlangsung satu tahap perubahan konsentrasi pereaksi sebanding dengan perubahan kecepatan reaksinya. Energi aktivasi 2 pada kenyataannya molekul molekul dapat bereaksi jika terdapat tumbukan dan molekul molekul mempunyai energi minimum untuk bereaksi.
Jika temperatur naik maka energi kinetik partikel partikel akan bertambah sehingga listrik untuk smp kegiatan pembelajaran 5.
Tumbukan antara dua partikel yang dapat bereaksi akan efektif jika. Reaksi yang hanya melibatkan satu partikel mekanismenya sederhana dan kita tidak perlu memikirkan tentang orientasi dari tumbukan. Reaksi yang melibatkan tumbukan antara dua atau lebih partikel akan membuat mekanisme reaksi menjadi lebih rumit. Misalnya pada reaksi sederhana a b o c jika konsentrasi a dijadikan 2 kali dan konsentrasi b tetap maka laju reaksi akan menjadi 2.
Reaksi yang hanya melibatkan satu partikel mekanismenya sederhana dan kita tidak perlu memikirkan tentang orientasi dari tumbukan. Peningkatan temperatur dapat mempercepat laju reaksi. Selain energi jumlah tumbukan juga berpengaruh.
Temperatur suatu sistem adalah ukuran rata rata energi kinetik dari partikel partikel pada sistem tersebut. Reaksi yang melibatkan tumbukan antara dua partikel sudah merupakan suatu yang tak pelak lagi jika keadaan yang melibatkan dua partikel dapat bereaksi. Jika tidak terjadi kontak maka tidak mungkin ada reaksi.
Banyaknya tumbukan memungkinkan tumbukan yang berhasil akan bertambah sehingga laju reaksi meningkat. Jika konsentrasi dinaikkan maka lebih banyak partikel akan lebih banyak terjadi tumbukan antar partikel. Dua zat tidak akan mungkin bereaksi satu sama lain tanpa ada kontak antara partikel penyusunnya entah itu molekul atom mapupun ion.
Reaksi yang melibatkan tumbukan antara dua partikel sudah merupakan suatu yang tak pelak lagi jika keadaan yang melibatkan dua partikel dapat bereaksi. Reaksi yang melibatkan tumbukan antara dua atau lebih partikel akan membuat mekanisme reaksi menjadi lebih rumit. Agar pereaksi dapat bereaksi terlebih dahulu harus terjadi tumbukan antara partikel partikel zat pereaksi tersebut.
Laju reaksi akan lebih cepat jika tumbukan antara partikel yang berhasil lebih banyak terjadi. Semakin banyak tumbukan akan semakin mepercepat terjadinya reaksi.
Laju Reaksi Pages 1 5 Text Version Anyflip
 Teori Tumbukan Pengertian Dan Faktor Yang Mempengaruhi Laju Reaksi
Teori Tumbukan Pengertian Dan Faktor Yang Mempengaruhi Laju Reaksi
Teori Tumbukan Pada Laju Reaksi Kimia Pdf Download Gratis
Modul Digital Laju Reaksi Astrid Maharani Pages 1 20 Text Version Anyflip
 Faktor Faktor Yang Mempengaruhi Kinetika Reaksi
Faktor Faktor Yang Mempengaruhi Kinetika Reaksi
 Laju Reaksi Asyik I Laju Reaksi Tumbukan
Laju Reaksi Asyik I Laju Reaksi Tumbukan
 Penjelasan Lengkap Tentang Teori Tumbukan Ilmu Kimia Untuk Indonesia
Penjelasan Lengkap Tentang Teori Tumbukan Ilmu Kimia Untuk Indonesia
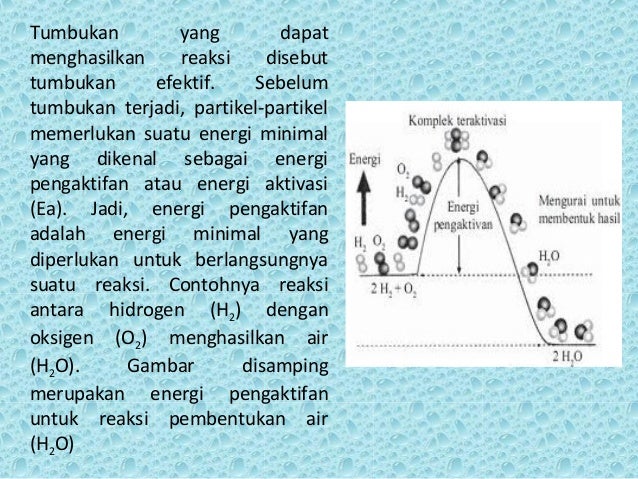 Kecepatan Reaksi 10 7 58 Smakbo
Kecepatan Reaksi 10 7 58 Smakbo
 Tolong Dibantu Ya Brainly Co Id
Tolong Dibantu Ya Brainly Co Id
Https Simdos Unud Ac Id Uploads File Pendidikan 1 Dir A72e4f059e1a3c36b836ec85a13558d0 Pdf
Faktor Yang Dapat Mempercepat Laju Reaksi
 Standar Kompetensi 3 Memahami Kinetika Reaksi Kesetimbangan Kimia Dan Faktor Faktor Yang Mempengaruhinya Serta Penerapannya Dalam Kehidupan Sehari Hari Ppt Download
Standar Kompetensi 3 Memahami Kinetika Reaksi Kesetimbangan Kimia Dan Faktor Faktor Yang Mempengaruhinya Serta Penerapannya Dalam Kehidupan Sehari Hari Ppt Download
 Kimia Laju Reaksi 1 Flip Book Pages 1 11 Pubhtml5
Kimia Laju Reaksi 1 Flip Book Pages 1 11 Pubhtml5
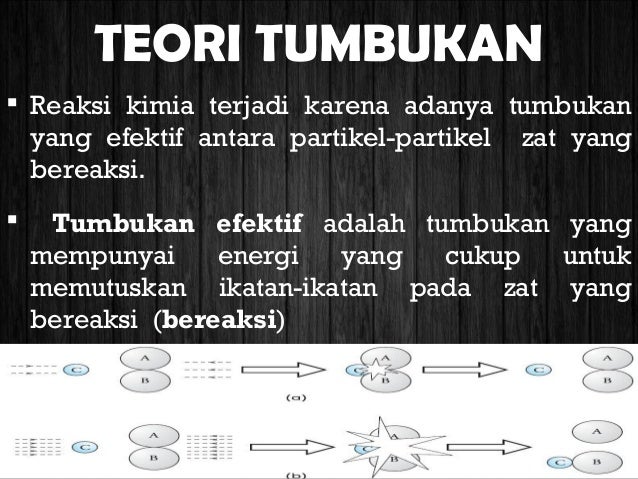 Teori Tumbukan Dan Laju Reaksi
Teori Tumbukan Dan Laju Reaksi
 Faktor Faktor Yang Mempengaruhi Laju Reaksi Ppt Download
Faktor Faktor Yang Mempengaruhi Laju Reaksi Ppt Download




