A tumbukan molekul untuk molekul yang tidak sama b tumbukan antarmolekul yang berbeda diameternya agar terjadi tumbukan yang efektif diperlukan syarat yaitu orientasi tumbukan molekul harus tepat. Kita dapat mengatur besarnya laju reaksi dengan cara mengubah faktor faktor yang memengaruhi laju reaksi.
A Teori Tumbukan Dewita Triani Putri
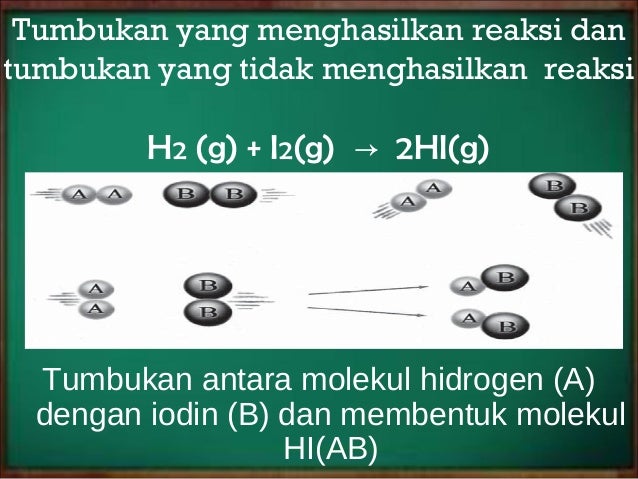
Lain halnya dengan reaksi antara senyawa senyawa kovalen yang tidak setiap tumbukan dapat menghasilkan reaksi.

Tumbukan yang menghasilkan reaksi. Besarnya laju reaksi dari suatu reaksi kimia dipengaruhi oleh beberapa faktor. Molekul molekul harus mempunyai orientasi tertentu agar tumbukan efektif untuk menghasilkan reaksi kimia. Pada setiap tumbukan yang terjadi antara ion positif dan ion negatif selalu dihasilkan reaksi.
B tumbukan yang memungkinkan terjadinya reaksi. Teori tumbukan adalah teori yang menjelaskan proses terjadinya reaksi. Tumbukan tersebut harus mencapai kekuatan atau tingkat energi tertentu dan terjadi pada arah yang tepat.
Hal ini berbeda dengan reaksi antara senyawa senyawa kovalen yang tidak setiap tumbukan dapat menghasilkan reaksi. Terdapat dua faktor yang dapat menentukan terjadinya tumbukan efektif yaitu. Namun perlu diingat bahwa untuk data sebuah percobaan dengan variasi beberapa faktor tidak semua faktor selalu berpengaruh.
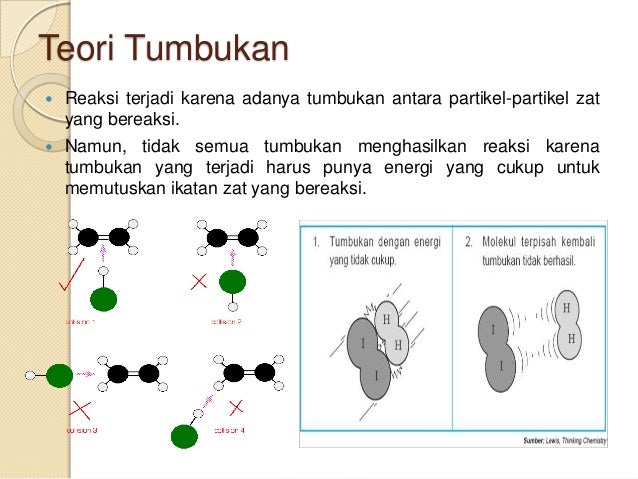
Pada gambar 3 7 ditunjukkan bahwa jumlah tumbukan yang orientasinya tidak memungkinkan terjadi reaksi umumnya lebih banyak daripada jumlah tumbukan yang memungkinkan terjadinya reaksi. Tumbukan yang dapat menghasilkan reaksi kimia dikenal dengan istilah tumbukan efektif. Tumbukan antar partikel disebabkan karena pergerakan partikel partikel dalam jalur yang tidak teratur.
Teori tumbukan berbunyi reaksi kimia terjadi karena adanya partikel partikel yang saling bertumbukan akan tetapi tidak semua partikel partikel yang bertumbukan akan menghasilkan reaksi kimia. Tentu tidak setiap tumbukan menghasilkan reaksi. Hal ini disebabkan tidak ada energi tumbukan yang diperlukan untuk memutuskan ikatan terlebih dahulu.
Teori tumbukan dalam menjelaskan laju reaksi. Pengaruh konsentrasi pada tumbukan. Semakin banyak tumbukan yang terjadi antar partikel reaktannya maka laju reaksinya semakin cepat.
Teori ini merupakan penjelasan kualitatif dan menjelaskan bagaimana sebuah reaksi kimia dapat berlangsung dan mengapa laju reaksi pada reaksi reaksi yang. Tumbukan antar partikel ini yang kemudian akan menghasilkan energi yang digunakan untuk memulai reaksi. Orientasi merupakan arah atau posisi.
Konsep teori ini adalah bahwa reaksi antara zat terjadi karena terjadinya tumbukan tabrakan partikel reaktannya. Gambarkan tumbukan yang menghasilkan reaksi. Pada setiap tumbukan yang terjadi antara ion positif dan ion negatif selalu dihasilkan reaksi sebab tidak ada energi tumbukan yang diperlukan untuk memutuskan ikatan terlebih dahulu.
Akan tetapi tidak semua tumbukan dapat menghasilkan produk reaksi hanya tumbukan efektiflah yang dapat menghasilkan produk reaksi. Teori tumbukan menyatakan bahwa ketika partikel reaktan yang sesuai saling bertumbukan hanya persentase tertentu dari tumbukan.
Tekukur 68 Topik Hidayat Teori Tumbukan
Modul Digital Laju Reaksi Astrid Maharani Pages 1 20 Text Version Anyflip
 Teori Tumbukan Pengertian Dan Faktor Yang Mempengaruhi Laju Reaksi
Teori Tumbukan Pengertian Dan Faktor Yang Mempengaruhi Laju Reaksi

 Kimia Kelas 11 Pengertian Dan Faktor Yang Memengaruhi Laju Reaksi
Kimia Kelas 11 Pengertian Dan Faktor Yang Memengaruhi Laju Reaksi
 Teori Tumbukan Dan Laju Reaksi
Teori Tumbukan Dan Laju Reaksi
 Teori Tumbukan Dan Faktor Faktor Yang Memengaruhi Laju Reaksi
Teori Tumbukan Dan Faktor Faktor Yang Memengaruhi Laju Reaksi
 Kimia Laju Reaksi 1 Flip Book Pages 1 11 Pubhtml5
Kimia Laju Reaksi 1 Flip Book Pages 1 11 Pubhtml5
 Perhatikan Gambar Berikut 33 Di Antara Ketiga Gambar Di Atas Tumbukan Manakah Yang Menghasilkan Brainly Co Id
Perhatikan Gambar Berikut 33 Di Antara Ketiga Gambar Di Atas Tumbukan Manakah Yang Menghasilkan Brainly Co Id
 Teori Tumbukan Pengertian Reaksi Dan Contohnya
Teori Tumbukan Pengertian Reaksi Dan Contohnya
 Bab 3 Laju Reaksi Ppt Download
Bab 3 Laju Reaksi Ppt Download
 Standar Kompetensi 3 Memahami Kinetika Reaksi Kesetimbangan Kimia Dan Faktor Faktor Yang Mempengaruhinya Serta Penerapannya Dalam Kehidupan Sehari Hari Ppt Download
Standar Kompetensi 3 Memahami Kinetika Reaksi Kesetimbangan Kimia Dan Faktor Faktor Yang Mempengaruhinya Serta Penerapannya Dalam Kehidupan Sehari Hari Ppt Download